我国科学家利用表观遗传编辑技术有效缓解天使综合征小鼠模型的症状
9月17日,中国科学院脑科学与智能技术卓越创新中心、上海脑科学与类脑研究中心周昌阳研究组联合杨辉研究组,熊志奇研究组与上海科技大学黄行许教授团队、东华大学等多家机构的科研人员,成功开发了一种新型表观遗传编辑工具,并首次在天使综合征(Angelman Syndrome,AS)小鼠模型中实现了对父源UBE3A基因的重新激活,显著缓解了该疾病模型的症状。这项研究发表在科学期刊《Cell Discovery》上,论文题为Epigenetic editing alleviates Angelman syndrome phenotype in mice by unsilencing paternal Ube3a。这标志着我国科学家在神经发育疾病领域取得了又一重要进展。

天使综合征是一种罕见的遗传性神经发育障碍,患者通常表现出严重的智力低下、语言发育迟缓、运动障碍以及癫痫等症状,给家庭和社会带来了沉重的负担。该疾病的根本原因在于母源的UBE3A基因功能丧失,而在神经元中特有的基因印记机制则导致父源的UBE3A基因沉默,这使得UBE3A蛋白的缺失在神经元中尤为显著。UBE3A-ATS长链非编码RNA通过调控印记基因表达,使得父源的UBE3A基因被沉默。这一机制使得基因修复和治疗变得极为复杂。
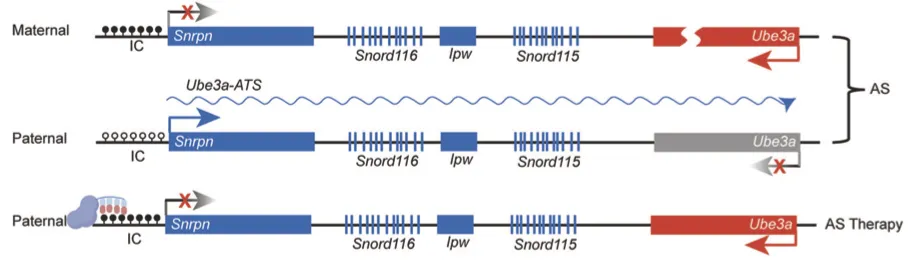
为了应对这一挑战,研究团队设计并开发了一种基于催化失活Cas9(dCas9)蛋白的表观遗传编辑工具,通过融合多个DNA甲基转移酶的功能域,能够精准地在小鼠基因组的特定区域引入DNA甲基化修饰。这种表观遗传编辑工具能够有效抑制UBE3A-ATS的表达,解除了对父源UBE3A基因的沉默,恢复了UBE3A蛋白在小鼠神经元中的表达水平。
在该研究中,科研人员通过在AS小鼠模型中引入这一表观遗传编辑系统,成功实现了UBE3A基因的重新激活,并通过行为学测试发现,这些经过治疗的小鼠在运动能力、学习记忆以及探索行为等方面均得到了显著改善。尤其是与未接受治疗的小鼠相比,治疗组小鼠在悬挂实验、转杆实验以及开放场实验中的表现显著优于对照组,表明UBE3A基因的重新激活对于缓解AS的症状具有关键作用。
除了行为学改善外,研究还发现,UBE3A蛋白在小鼠大脑中的表达量显著增加,尤其是在海马、皮层和小脑区域,表明这一表观遗传编辑工具能够在神经元中广泛且持久地激活目标基因。这一成果展示了表观遗传编辑在疾病治疗中的巨大潜力,尤其是在神经系统疾病领域。
尽管当前的研究仍处于动物模型阶段,但这一表观遗传编辑技术的成功为未来天使综合征及其他基因印记相关疾病的治疗提供了新的思路。与传统的基因编辑技术相比,表观遗传编辑具有不改变DNA序列的优势,使得基因修饰更加可控且可逆,避免了潜在的脱靶效应和基因组不稳定性问题。此外,该系统在治疗过程中只需短暂表达即可实现长期效果,表明其在临床应用中的巨大潜力。未来,研究团队计划进一步优化这一技术,并探索其在临床治疗中的可行性,以期为天使综合征患者带来全新的治疗方案。
华东理工大学副研究员刘亚京博士、中国科学院脑科学与智能技术卓越创新中心娄森森博士、李进慧博士为共同第一作者。中国科学院脑科学与智能技术卓越创新中心、上海脑科学与类脑研究中心周昌阳青年研究员、杨辉研究员、熊志奇研究员和上海科技大学黄行许教授为共同通讯作者。该研究得到了国家自然科学基金、科技部2030重大脑科学专项、上海市科委等项目的资助。