中国科学家团队合作开发出脑钙化症反义核苷酸疗法
2024年8月8日,中国科学院脑科学与智能技术卓越创新中心、上海脑科学与类脑研究中心熊志奇研究员与福建医科大学附属第一医院陈万金教授、临港实验室程学文副研究员团队合作在神经科学期刊《Neuron》杂志发表了题为“Antisense oligonucleotides enhance SLC20A2 expression and suppress brain calcification in a humanized mouse model”的研究论文。该研究发现调控脑内磷酸根浓度的关键基因,同时也是脑钙化主要致病基因SLC20A2的新型可变剪接调节机制,并据此开发出了反义寡聚核苷酸疗法(ASO)。ASO药物通过增强脑内磷酸根的转运效能,显著降低脑内磷酸根离子的浓度,进而遏制钙化的发生,改善脑钙化的相关症状。这一成果标志着我国在脑钙化症的基因治疗领域取得了重要的突破。
脑钙化是脑功能障碍的重要原因之一,在老年人群发生率高达20%,远高于阿尔兹海默症、帕金森氏症等疾病。生理性脑钙化斑块较小且进展缓慢,但病理性脑钙化症发病早,进展快,可出现严重的神经与精神症状,如运动障碍、言语不清、痴呆、头痛、头晕和抑郁等。部分脑钙化患者呈高度家族性遗传,代表性的原发性家族性脑钙化症,患病率近0.6%,通常在40至60岁之间发病。目前在临床上脑钙化症没有基于病理机制的有效干预手段。
通过基础与临床的长期紧密合作,中国科学家在脑钙化症致病基因的鉴定与研究领域取得了一系列重要的成果。2012年,刘静宇团队鉴定了原发性基底节钙化首个显性突变致病基因SLC20A2。2018年,陈万金团队与熊志奇团队合作发现首个隐性突变致病基因MYORG。SLC20A2编码一种钠磷共转运体PiT2,其杂合突变占所有已报道原发性基底节钙化病例的60%,造成PiT2表达单倍体剂量不足,导致患者脑脊液磷酸根水平显著上调和钙化发生。
本次研究从数百个脑钙化患者中鉴定了六个原发性基底节钙化家系携带SLC20A2基因的内含子突变并发现SLC20A2基因内含子区域存在着一些隐蔽外显子序列(Cryptic exon),且其中包含提前终止密码子(Premature termination codon)。正常情况下,一条染色体上的SLC20A2转录产物,近一半会整合有隐蔽外显子序列。在流水线一样的mRNA加工过程中,这部分携带有提前终止密码子标签的不合格mRNA转录本会被细胞内的质检机制降解。内含子序列变异造成该条染色体上几乎所有SLC20A2 pre-mRNA序列均变成不合格品,造成患者脑内PiT2表达不足和脑内磷酸根稳态失衡, 最终导致脑钙化发生。基于此原理构建的整合人源化突变内含子序列的钙化模型小鼠,出现与临床患者类似的脑脊液磷酸根水平显著升高和年龄依赖的脑钙化病理特征。
在此基础上,研究团队设计筛选了靶向SLC20A2隐蔽外显子序列的ASO药物。在SLC20A2杂合突变患者来源的人成纤维细胞上,ASO干预可以显著上调SLC20A2的mRNA和蛋白质表达。人源化小鼠模型脑室内一次ASO给药,可以实现持续4个月以上的SLC20A2表达修复。进一步检测发现,ASO可以降低脑钙化小鼠的脑脊液 Pi水平,并显著抑制脑钙化的发生与进展。此外,脑钙化沉积和磷稳态失衡引起的神经元退行性病变、神经炎症等病理变化也被ASO有效改善。
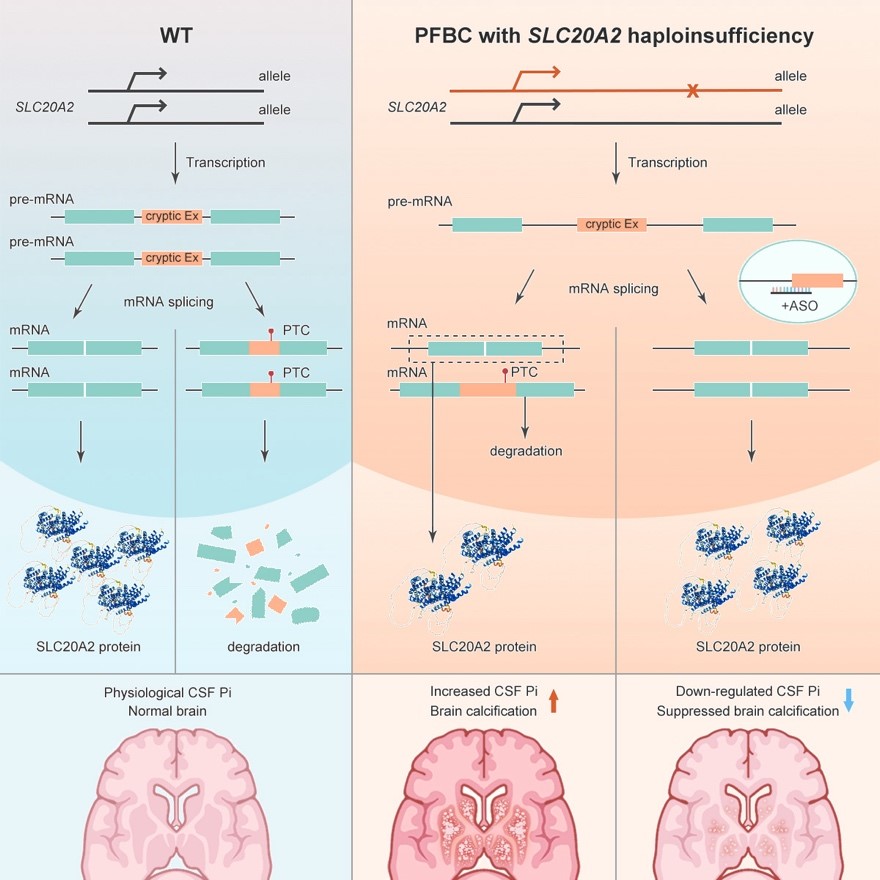
ASO疗法的干预原理示意图
本研究发现家族性脑钙化症致病基因SLC20A2的新型可变剪接调节机制,并开发了基于反义寡聚核苷酸疗法,是基础研究“源自临床、回馈临床”的成果体现。ASO干预策略,有望为脑内磷稳态失衡相关的脑钙化患者提供一种病因性的干预方案,阻滞或逆转钙化病理进程。
本项目得到了科技创新2030重大项目《脑科学与类脑研究》、国家自然科学基金、福建省科委和卫健委、上海市科委和临港实验室的经费资助。