研究解析Tbx2决定耳蜗毛细胞命运选择的分子机制
2024年 6 月 5日,《The Journal of Neuroscience》期刊以封面文章在线发表了题为《Tbx2在不同年龄转分化耳蜗外毛细胞命运》的研究论文,该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、神经科学国家重点实验室、上海脑科学与类脑研究中心刘志勇研究组完成。该研究探究了转录因子Tbx2(内毛细胞发育的关键因子)过表达能否转分化不同发育阶段的小鼠耳蜗外毛细胞及其前体细胞,以及其转分化的程度。同时研究人员还探讨了Tbx2与外毛细胞发育成熟相关的关键转录因子Ikzf2之间的相互拮抗的作用机制,为深入理解耳蜗内、外毛细胞命运决定的作用机制提供了新的理论基础。
Tbx2是耳蜗内毛细胞命运决定、分化和命运维持的关键因子,Tbx2功能缺失导致内毛细胞转分化为外毛细胞。目前,听觉领域内仍有几个关键的问题亟待澄清:1)过表达Tbx2能否转分化外毛细胞到内毛细胞?2)Tbx2转分化外毛细胞是否具有年龄依赖性?3)外毛细胞中过表达Tbx2是否可以完全转分化为内毛细胞?4)Tbx2转分化外毛细胞为内毛细胞的分子机制是什么?
为了回答以上4个问题,研究人员构建了Tbx2条件性过表达小鼠模型(简称Tbx2OE),然后分别在新生小鼠和成年小鼠耳蜗外毛细胞中过表达Tbx2,发现均可以把外毛细胞转分化为内毛细胞样的细胞,并表达内毛细胞的标记物vGlut3、Slc7a14和Otoferlin,同时伴随外毛细胞标记物Prestin的渐进性消失,说明外毛细胞对Tbx2的响应不受年龄的影响。在胚胎期外毛细胞前体细胞中过表达Tbx2则直接产生内毛细胞标记物Fgf8 和vGlut3 的内毛细胞样细胞,无Bcl11b和Prestin表达(图1)。同时,扫描电子显微镜结果显示,外毛细胞前体细胞过表达Tbx2产生的类内毛细胞的静纤毛束与内源性内毛细胞相似(图1),说明细胞发育状态越早、细胞可塑性越高,对Tbx2的响应作用越强。
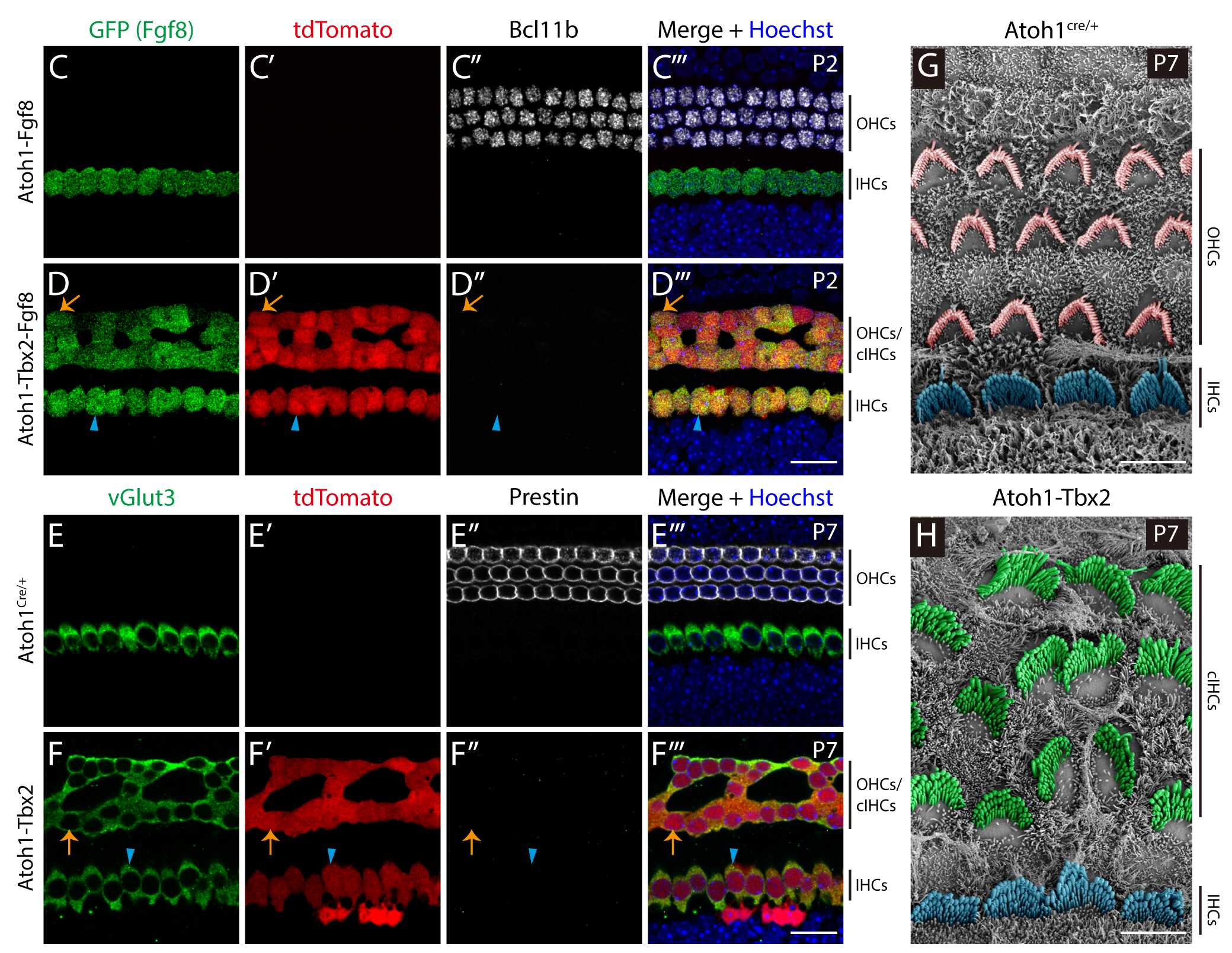
图1. 过表达Tbx2导致外毛细胞前体细胞分化发育为与内源性内毛细胞相似的类内毛细胞。外毛细胞前体细胞过表达Tbx2,产生Fgf8 / vGlut3 /Bcl11b-/Prestin-的类内毛细胞(D-D’’’和F-F’’’),而对照组中则为Bcl11b /Prestin /Fgf8-/ vGlut3-的外毛细胞(C-C’’’和E-E’’’);扫描电子显微镜检测结果显示对照组(G)中外毛细胞静纤毛束为“V”字形,而实验组(H)中在相应区域产生的类内毛细胞静纤毛束和内源性内毛细胞一致,呈“一”字形。黄色箭头表示转分化的类内毛细胞,蓝色三角形指示内源性内毛细胞。
为了进一步探索Tbx2转分化外毛细胞为内毛细胞的分子机理,研究人员通过单细胞Smart-seq对类内毛细胞、内源性外毛细胞和内源性内毛细胞进行比较分析,发现在类内毛细胞中有85.6%的内毛细胞特异表达基因出现上调,同时38.6%的外毛细胞特异表达基因出现下调,提示Tbx2不能使外毛细胞完全转分化为内毛细胞。研究人员发现外毛细胞发育成熟关键因子编码基因Ikzf2受到Tbx2的负调控,推测Ikzf2可能与Tbx2存在于相同的细胞命运调控通路,并位于Tbx2的下游,且行使与Tbx2相反的生物学功能。为了进一步证实该推测,研究人员构建了在外毛细胞中同时过表达Ikzf2和Tbx2的小鼠模型(简称Slc26a5-Tbx2-Ikzf2),确定了Ikzf2对Tbx2的生物学功能具有明显的拮抗作用(图2)。该研究揭示了Tbx2-Ikzf2模块对耳蜗毛细胞命运抉择的调控机制,为将来深入解析该网络调控通路奠定了扎实的研究基础。
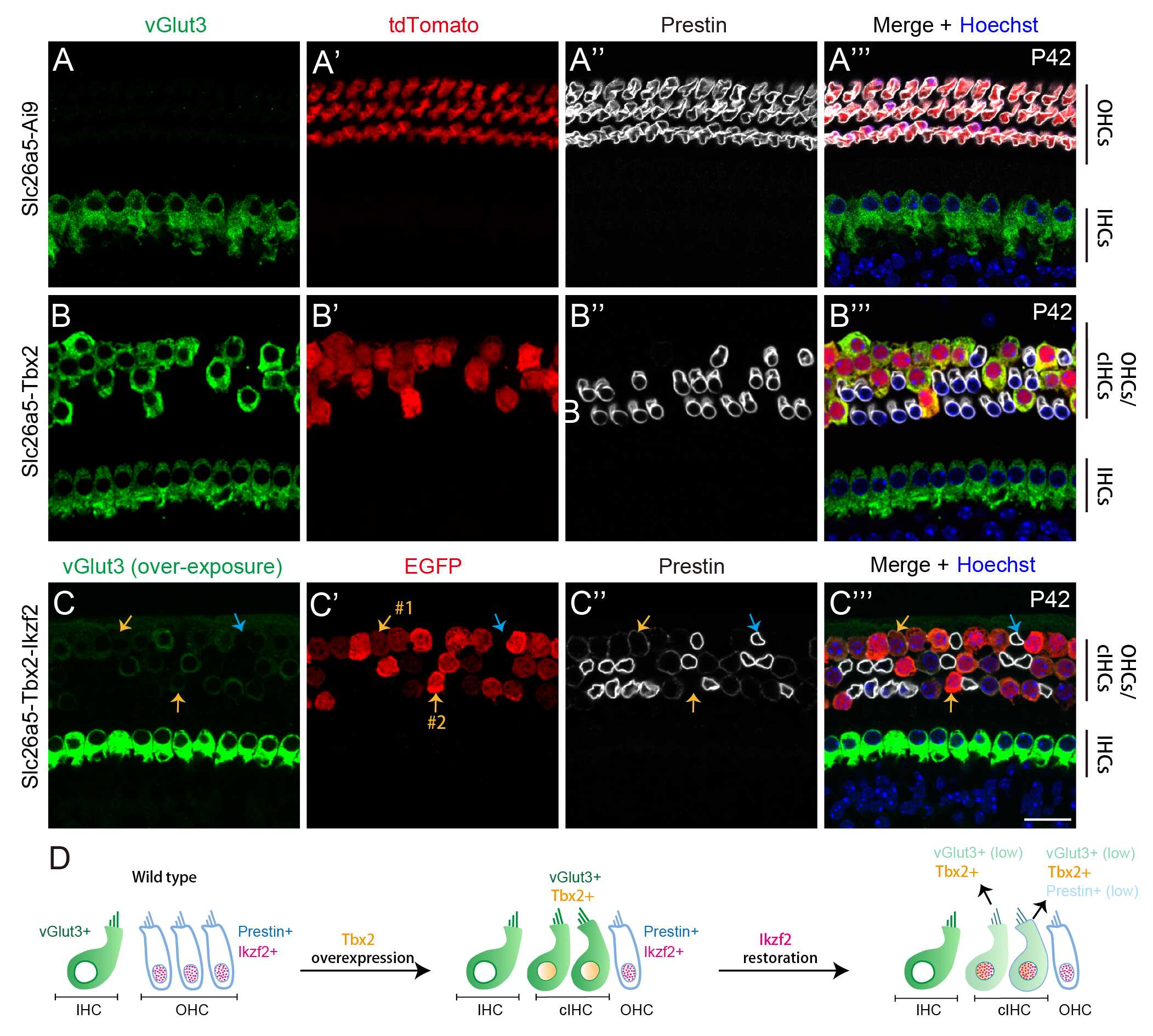
图2. 在外毛细胞中Ikzf2对Tbx2发挥了相反的生物学功能。(A-C’’’)分别为阴性对照组(A-A’’’)、Tbx2OE(B-B’’’)和OHCs-Tbx2OE-Ikzf2OE(C-C’’’)耳蜗毛细胞vGlut3、Prestin和tdTomato免疫组织化学分析;在OHCs-Tbx2OE中tdTomato 细胞的vGlut3表达水平与内源性内毛细胞相当(甚至略高于内源性内毛细胞),而Prestin则完全消失;相反,OHCs-Tbx2OE-Ikzf2OE中EGFP 的大部分外毛细胞中vGlut3信号受到严重的抑制,同时Prestin信号则仍有微弱的表达,说明Ikzf2对Tbx2的生物学功能具有拮抗作用;蓝色和黄色箭头分别指示内源性外毛细胞、Prestin (弱)/vGlut3- (#1)和vGlut3 (弱)/Prestin-(#2)的细胞。(D)Ikzf2拮抗外毛细胞中Tbx2生物学功能的示意图。
中国科学院脑智卓越中心刘志勇研究员和副研究员李响为该论文的共同通讯作者,副研究员毕政鸿为第一作者,脑智卓越中心博士研究生任旻蕙、高级实验师贺顺姬及上海交通大学第九人民医院张宇博士做了重要贡献。同时上海交通大学第九人民医院宋雷教授对本课题电生理内容给予了重要的指导。中国科学院脑智卓越中心光学平台、电镜平台、分子细胞技术平台和啮齿类实验动物平台提供了重要技术支持。该研究获得了国家自然科学基金委员会、科技部、上海市科委和中国科学院的资助。