G60脑智科创基地研究进展:合作研究改造微型 TnpB-ωRNA工具用于高效基因编辑与疾病模型治疗
近年来CRISPR基因编辑技术得到了快速的发展,但大部分CRISPR工具尺寸较大,如Cas9、Cas12蛋白尺寸通常超过1000个氨基酸,限制了在体内基因编辑治疗方面的应用。最近研究表明Cas12家族的祖先蛋白TnpB核酸酶具有最小的蛋白尺寸。然而,微型TnpB核酸酶在动物体内的活性和治疗潜力尚待研究。
2024年1月27日,临港实验室、上海脑科学与类脑研究中心胥春龙团队联合辉大基因周英思团队、新加坡国立大学胡纯一团队在《自然-通讯》(Nature Communications)学术期刊上发表研究论文“Engineering a transposon-associated TnpB-ωRNA system for efficient gene editing and phenotypic correction of a tyrosinaemia mouse model”, 研究团队通过工程化改造优化了TnpB-ωRNA基因编辑工具并证明了该技术能够在小鼠模型中进行高效的体内编辑,而且通过单个腺相关病毒(AAV)向肝脏递送改造后的TnpB-ωRNA,成功实现了对小鼠模型中酪氨酸血症的治疗,预示微型TnpB编辑工具在疾病基因编辑治疗方面的巨大潜力。
研究团队通过设计高效的报告系统,对TnpB的ωRNA进行了多轮工程化改造,获得了序列较短且高活性的ωRNA变体(ωRNA*)。为了探究TnpB-ωRNA*在小鼠细胞和组织中的活性,研究团队针对小鼠基因的数个位点设计了gRNA,发现 TnpB-ωRNA*具有最佳的编辑效率,并且其在小鼠胚胎中也表现出良好的编辑效果,同时也成功制备了杜氏肌营养不良症的模型小鼠。研究团队还验证了单个AAV递送TnpB-ωRNA*在成年小鼠中治疗疾病的可行性,团队使用I型酪氨酸血症(HTI)小鼠模型,这是一种由Fah基因功能缺失突变引起的致命代谢性疾病模型。过去的研究表明,该疾病可以通过编辑Hpd基因进行治疗。研究团队设计靶向Hpd基因的AAV-TnpB-ωRNA*载体对疾病小鼠进行治疗。结果显示,对照组小鼠在65天内全部因为肝损伤死亡,而AAV- TnpB-ωRNA*治疗可以挽救模型小鼠的死亡,并且治疗组小鼠在整个观察期内表现出体重的稳定增长,而对照组小鼠的体重则不断减轻直至死亡。此外,与对照组小鼠肝脏相比,治疗组小鼠的肝脏中发现了高水平Hpd基因编辑效率,其肝切片免疫染色和western blot也显示Hpd表达水平显著降低。同时,H&E染色与肝脏相关代谢生物标志物检测结果表明,HT1小鼠在接受AAV- TnpB-ωRNA*治疗后,其功能失调的酪氨酸代谢也得到了显著改善。
为了证明TnpB-ωRNA*在更多疾病干预中的广泛应用前景,研究团队也利用其他基因靶点进行了测试,例如对治疗遗传性血管性水肿(HAE)有效的Klkb1基因靶点。小鼠实验结果证明,AAV-TnpB-ωRNA*对Klkb1基因也显示出较好的成体编辑效率。最后,研究者使用PEM-seq技术对TnpB-ωRNA基因编辑细胞进行了全基因组脱靶分析, 未检测到TnpB-ωRNA介导的脱靶编辑事件,说明TnpB-ωRNA具有较好的基因编辑安全性。
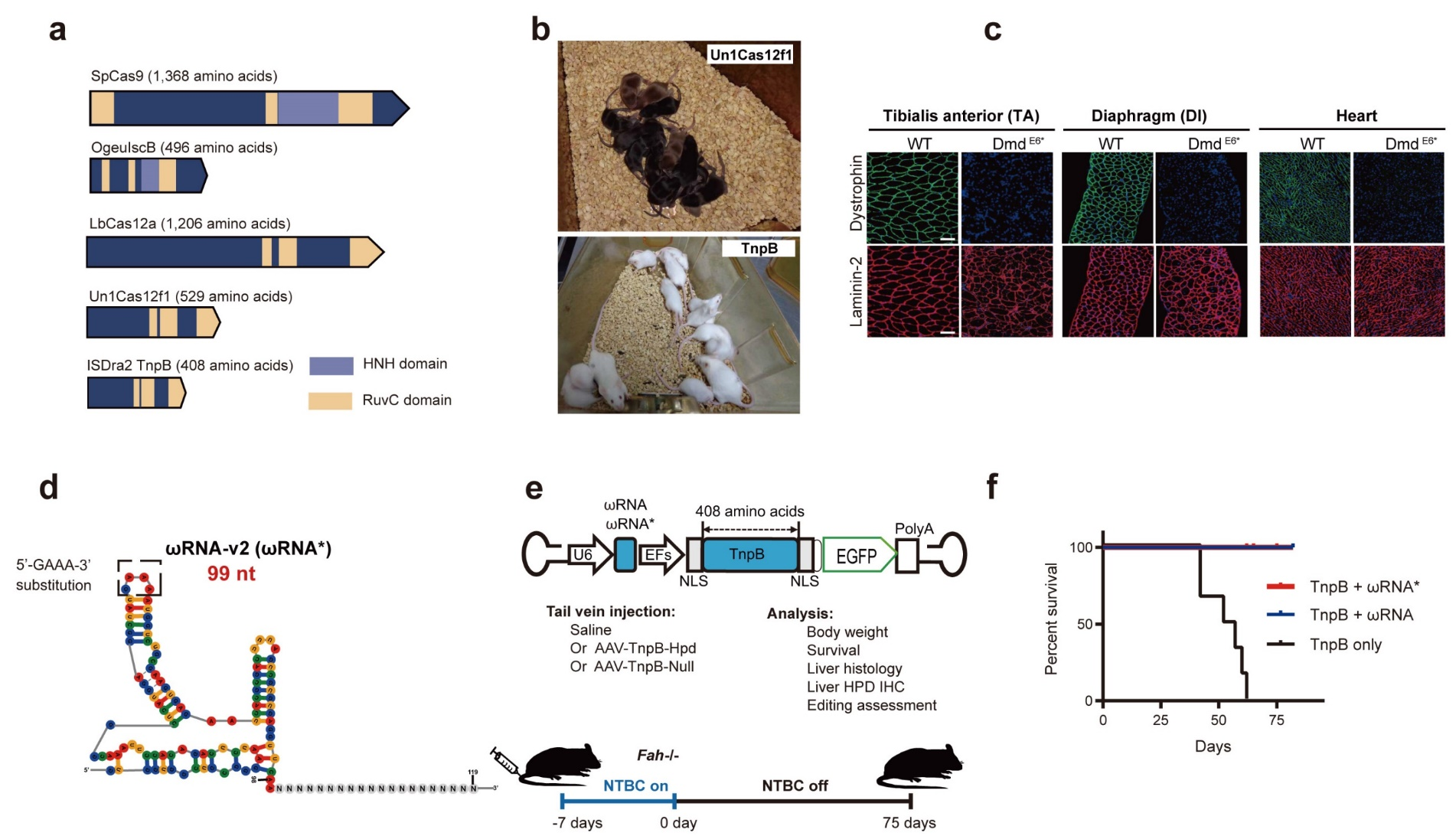
图1. TnpB-ωRNA基因编辑系统的改造与应用
(原文链接https://www.nature.com/articles/s41467-024-45197-z)
本研究首次展示了工程化改造ωRNA*可以显著提高TnpB编辑活性,而且证明了改造后的TnpB-ωRNA*在模型制备和遗传疾病基因编辑治疗中的应用潜力,为将来改造和优化TnpB-ωRNA*基因编辑技术来干预更多疾病奠定了基础。该研究得到了位于G60脑智科创基地的上海脑科学与类脑研究中心-临港实验室共建的实验动物中心、光学成像展示平台和基因编辑平台的大力支持。